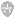起搏动态 | 叶利方摘译——通过植入式远程传输装置对房颤发生中电重构的个性化监测

心房颤动(AF)被认为是一种日益增长且不可避免的世界性流行病,造成严重的经济和社会负担。无创体表心电图(ECG)是诊断AF的简单方法,通过植入装置和心房导线获得的心内记录也可以发现AF。体表和心内AF记录都能显示快速的心房激动频率(AAR)和不规则的心房活动。
AF是一种从短期阵发到长期持续发作的进展性心律失常,增加住院和不良心血管事件风险。AF本身引起心房心肌进行性的功能和结构变化,从而促进AF长期持续发生。伴随的遗传和心血管疾病为AF的启动和持续奠定了基础,但并不能提供AF重构进展过程的个体化信息。
AF引起离子通道改变,导致动作电位时程缩短,并进展为快速的AAR,直到达到完全电重构状态。随着AF的发展,心房的机械和结构也发生进行性变化,这进一步降低了有效节律控制的可能性。在持续性AF动物模型中,心房电重构(AER)的时相呈现出从动物到动物的明显进展,其重构斜率对药物治疗的效果敏感。尽管监测AER可能在临床上具有诊断和治疗意义,但尚未证明AER也遵循患者特定的模式。
2019年11月《Europace》在线发表了西班牙马德里Jose´ Marı´a Lillo-Castellano 等的研究结果,该研究从植入式心脏转复除颤器和/或再同步治疗(ICD/CRT-D)与传统起搏器人群中获取AF记录,来研究AARs和AER进展的时相,并探讨潜在的临床条件对房颤AER进程的影响。
研究方法
研究设计:ICD/CRT-D数据从51个西班牙的观察性多中心病案中获取,包括在UMBRELLA研究中(NCT01561144,clinicaltrials.gov)。此数据库是一个基于云平台的大数据库,能够实现自动和非侵入性的数据传输。该数据库纳入2011年8月至2017年11月植入美敦力ICD/CRT-D的4618名患者。其中2074名植入双腔ICD/CRT-D和远程监测的患者作为研究对象。起搏器数据来自两个西班牙中心的回顾性观察研究。纳入了所有从2009年12月至2018年12月植入双腔Microport起搏器的患者。心房导线常规置入右心耳。
数据筛选与节律分类:UMBRELLA科学委员会首先回顾分类了27461个记录在ICD/CRT-D的事件。三名独立研究人员使用定制的基于Java的软件对从远程监测传输及常规监测设备中获取的记录进行回顾分类。剔除信号质量差的记录。所有双极导线(tip-ring;图2A)记录的绝对不规则,激动频率>3Hz,持续>3s的AF记录都被纳入研究中。在监测记录中手动选择AF发生和终止节段。必要时手动删除信号伪影。
图2 样本信号处理和代表AER的时相。(A)植入式双腔心脏转复除颤器,AF发作期间获取心房双极心电图。(B)AF进展期的AAR时相,从阵发性AF早期AER(浅绿色背景)到持续性AF(亮红色背景)完成AER。(C)B中箭头向下的样本记录,代表不同AER阶段。(D)与样本记录相关的功率谱和DF值。
根据发作持续时间,将AF分为阵发性或持续性。持续时间<7d为阵发性AF,>7d为持续性AF。起搏器患者的AF分类从临床记录中进一步确认。在ICD/CRT-D患者中,无发作持续时间的AF通过后续记录分类,间隔至少7d的两个或两个以上连续远程传输的AF被认为是持续性AF。
AAR计算:从存储事件(ICD/CRT-Ds和起搏器)中获得128Hz的心房信号,远程传输(仅ICD/CRT-Ds)获得256Hz的数据。信号频率低于0.5Hz被高通滤波滤除。ICD/CRT-D及起搏器组AF平均持续时间分别为9.6[5.03,10.00]s和14.6[10.6,19.7]s。使用频谱分析和快速傅立叶频率转换来计算局部右心房AAR。10Hz以下频谱按波段内最高峰频谱的振幅进行标化。主频率(DF)定义为该频段内最高的频率。分析每段AF记录的DF值,必要时使用定制的Java工具手动校正为估计的平均局部AAR。平均局部激动间期倒数可以用DF峰值计算[估计平均周长(ms)=[(1/DF)×1000];图2B-D]。
AER的时相分析:由DF推算出的AAR按日期排序来描述随访期间的变化(图2B)。从阵发性AF到持续性AF伴完全电重构,患者AER的进展通过重构斜率来绘制。使用Java工具手动选择电重构前后的节段。由于AF期间的心房激动不规则,且DF值在连续记录过程中可能有轻微变化,所以使用重构前后节段的中位DF值来计算两个阶段间的差异。最后将DF值进行线性回归来自动计算AER斜率(图2B)。
研究结果
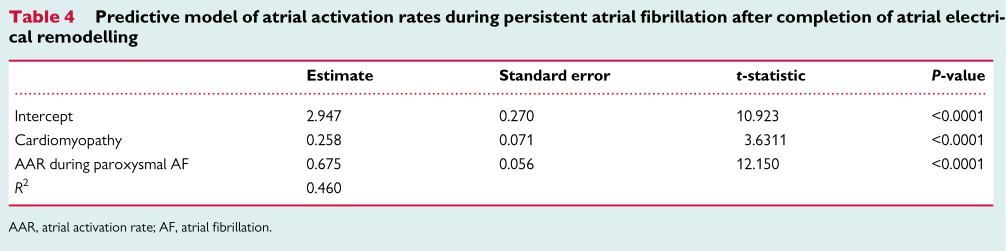
共纳入830例患者(87例起搏器)的34712个AF记录。起搏器患者的随访时间与ICD/CRT-D患者相似(3.4[1.7,5.3]和3.4[1.9,4.3]年),年龄明显高于ICD/CRT-D患者(78.3[73.1,85.3] vs.67.2[59.3,73.7]岁,P<0.001),大部分起搏器患者左室射血分数(LVEF)>35%。216例持续性AF患者(16例起搏器)记录到从重构前到完全重构的AER完整进程。543例ICD/CRT-D患者和71例起搏器患者为阵发性AF(随访期间未进展为持续性AF)或持续性AF(随访期间反复传输AF)。大部分ICD/CRT-D为一级预防(71.7%),基础心脏疾病主要为缺血性心肌病(ICM,50.6%)和非缺血性扩张型心肌病(DCM,33.2%),LVEF<35%的患者占73.4%(表2)。
表2 不同AF人群基线临床及人口学特征
AF分期决定AAR和结构改变
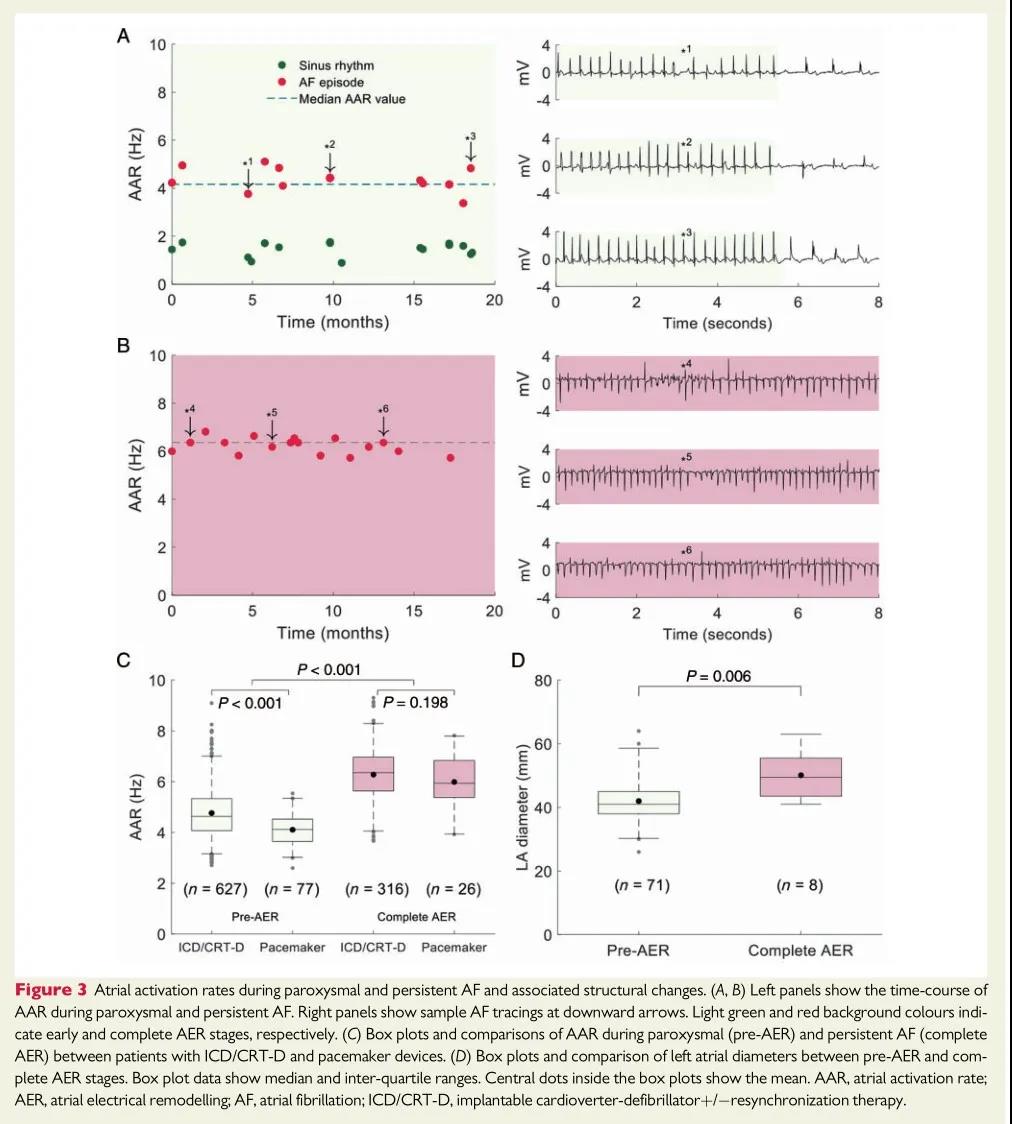
阵发性AF患者的AAR较持续性AF患者慢。(图3A,B)显示了两个具有代表性的病例。与阵发性AF的重构前阶段相比,AER完成后的AAR增加了约30%(图3C)。这些数据反映了两个电重构阶段的存在,它们之间有一个中间期。尽管与ICD/CRT-D患者相比,起搏器患者阵发性AF发作时的AAR更慢(4.12[3.64,4.53]Hz vs.4.63[4.07,5.34]Hz,P<0.001),但AER完成后两组AAR均增加。持续性房颤AER完成后,两组AAR无差异(图3C)。在起搏器组中,与早期电重构阶段相比,完成AER后的LA直径明显增大,反映出结构重构的进展(50[40,56]mm vs 38[41,45]mm,P=0.006;图3D)。
图3 阵发性和持续性AF期间AAR和相应的结构变化
对ICD/CRT-D患者AAR的进一步分析及AER(n=200)全程监测显示,阵发性AF发作期间,CRT-D患者较ICD患者AARs显著减慢(4.15[3.48,4.80]Hz vs.4.45[3.81,5.25]Hz,P=0.005)。但在持续性AF完成AER后,两组AARs无差异。CRT-D患者的双室起搏比例为95.4[89.3,99.0]%。在起搏器患者中,I/III类抗心律失常药物有降低AARs的趋势。
AER完成后AAR的预测
在完整监测AER的ICD/CRT-D患者中,阵发性AF和完成AER后持续性AF的AARs显著相关(R2=0.424,P<0.001;图4A)。ICM患者完成AER后的AARs显著低于DCM或其他结构性心肌病患者(6.30[5.6 0,6.70]Hz vs.6.48[5.96,7.20]Hz,vs.6.93[5.61,7.45]Hz,P=0.015和P=0.036,图4B)。LVEF≤35%与LVEF>35%的患者相比AARs更低(6.30[5.61,6.79]Hz vs.6.84[5.72,7.38]Hz,P=0.013)。(表3)为AER完成后持续性AF期间的基线临床特征及AAR相关变量的单变量分析。应用潜在心脏病的预测模型,阵发性AF早期AER阶段AAR和完成AER后持续性AF的AAR显著相关(表4;R2=0.460)。
表3 AER完成后持续性AF期间AAR相关变量的单变量分析
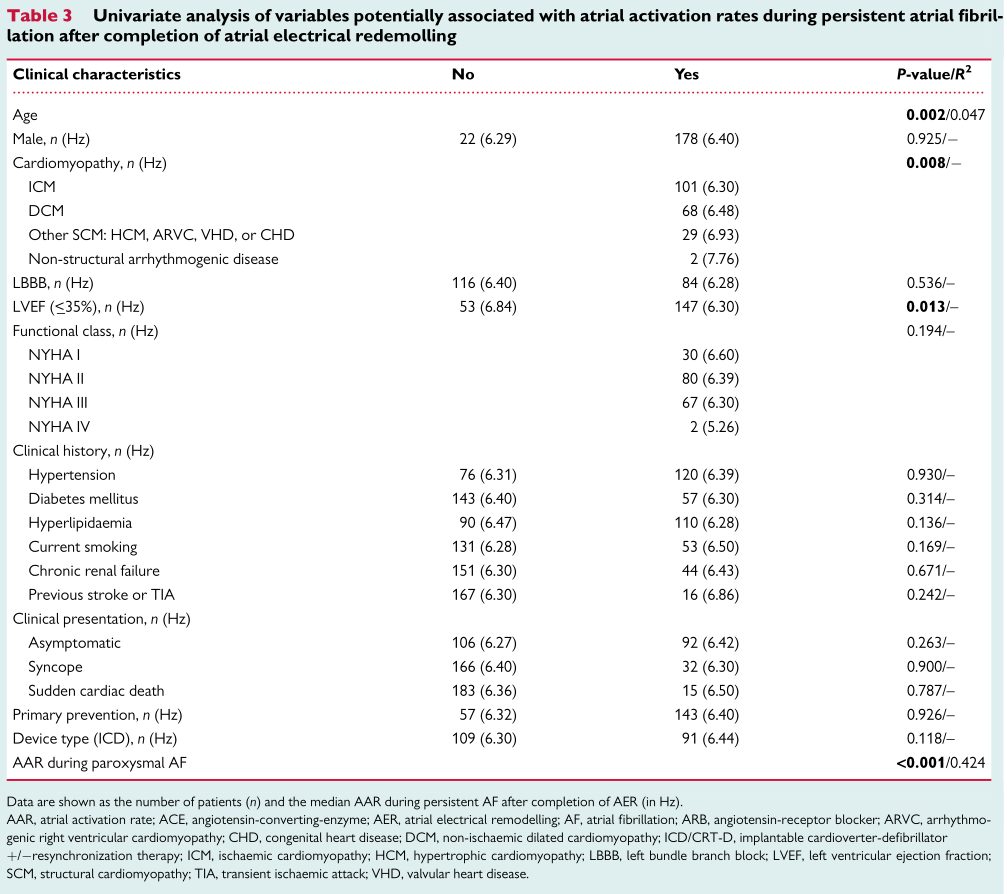
表4 AER完成后持续性心AF期间AAR的预测模型
AF进展显示患者特定的电重构模式
AF进展期具有患者特定的模式,即AARs斜率的对数与完成AER时间的对数密切相关,在ICD/CRT-D和起搏器人群均是如此(分别R2=0.852和R2=0.853,P<0.001;图4C)。ICD/CRT-D患者基线临床变量的单变量分析显示,只有左束支传导阻滞与完成AER时间相关(P=0.036)。多变量分析未发现临床变量与完成AER时间具有相关性。
图4 监测和预测AER的完成时间
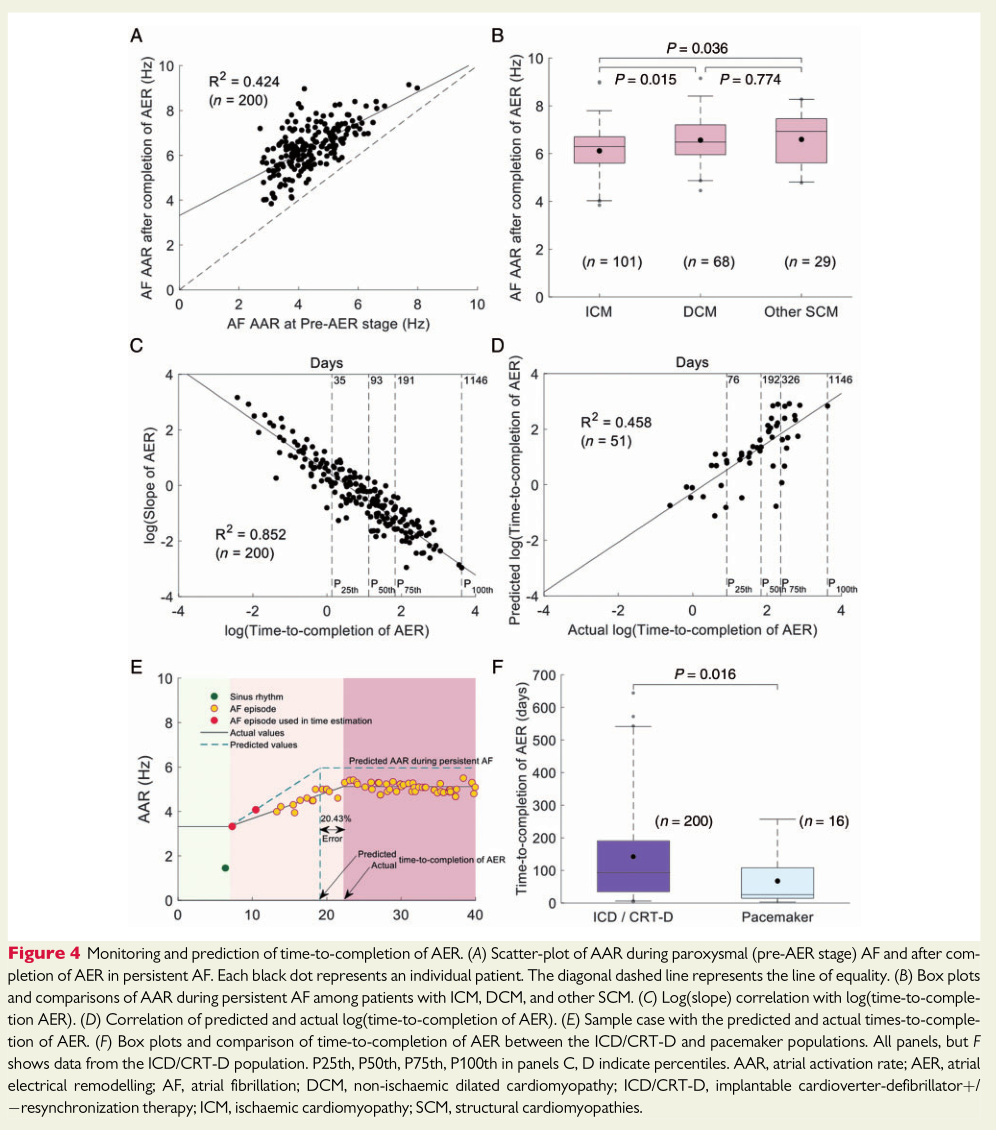
通过ICD/CRT-D亚组人群(n=51)的AF远程监测可以估计患者特定的AER完成时间。因此,从阵发性AF到持续性AF完成电重构,AER完成过程的AARs预测值和AARs预期变化的25%计算斜率与AER完成时间相关(R2=0.458;图4D,E)。AER完成时间对数的定量误差显示,中位数33.56%[12.72,57.06]。
起搏器患者的AER完成时间比ICD/CRT-D患者显著缩短(分别24.9[14.3,108.2]天 vs 93.5 [36.6,190.5]天;P=0.016;图4F)。无法确定造成这种差异的潜在原因,可能与起搏器患者年龄较大有关。
局限性
这项研究设计没有使用能提高AER斜率评估的特定标准来获取远程监测的传输信号。此局限在起搏器装置中更为明显,因其无法远程传输,且只能从存储事件中获得AF记录。
本研究的重点是通过长期随访获取AF记录以监测AER。然而,由于在ICD/CRT-D患者中获取数据的研究设计限制,诸如结构重构等变化不能得到全面的评估。由于官方数据表中没有用药史,所以无法获得特定药物对AAR和AER进展作用的更多有意义的数据。与起搏器患者相比,ICD/CRT-D患者AER进展较慢可能与其接受上游治疗(根据ICD/CRT-D患者的既往史)的比例更高有关。这项研究表明,无论药物对AF重构斜率的潜在影响如何,利用目前的技术可以有效地监测和估计AER。本研究所采用的方法尚未用于临床实践,需在起搏装置和远程监测平台进行前瞻性系列研究进一步验证。
结论
AF进展显示出患者特定的AER模式,AER模式可以通过计算每个患者AAR斜率变化和潜在的心脏状态来评估。