起搏动态 | 吴圣杰摘译——感染活动期间同期植入无导线起搏器和原导线移除

随着心脏植入型电子装置(CIED)植入率的提高,因感染导致CIED摘除的需求也日渐增加。当前指南建议在已证实和疑似植入装置感染的情况下,需移除血管内、外的所有部件,并进行充分的清创、抗感染治疗。目前关于CIED摘除后再次植入装置的最佳时机研究有限。在一项大型、多中心的研究中,感染装置移除到再次植入起搏器的中位数时间为10天,植入新电子装置人群的6个月感染复发率为2%,而原装置未移除人群感染复发率高达11.3%。常规在重新植入起搏装置前等待3-14天,但对起搏依赖患者,具有一定风险。如植入临时起搏器,会增加感染、脱位和穿孔等风险。
MICRA (MedtronicInc, Minneapolis, MN)经导管无导线起搏系统为此类患者提供了另一选择。因无传统的脉冲发生器及经静脉导线,MICRA无囊袋和导线相关感染风险。MICRA的快速内皮化使其很快包裹于心肌内,装置表面暴露部分少,二甲苯涂层减少细菌粘附,这些均可降低感染风险。与经股静脉临时起搏电极相比,无导线起搏在术中提供更具优势的“临时起搏”功能。2020年3月,纽约北岸大学医院David Chang医生在《JCE》杂志发表文章,介绍在活动性感染时,同期植入MICRA无导线起搏器和拔除原静脉导线的相关经验。
研究方法
研究回顾了2018年1月至2019年11月期间所有的MICRA无导线起搏器植入病例,及同一过程中因感染行拔除原静脉导线的患者。电极导线拔除与MICRA植入手术于杂交手术室全麻下进行,且心脏外科医生和ECMO做好准备。先植入MICRA,后取出感染的CIED,这样起搏依赖患者无需植入临时起搏电极。MICRA植入后,18Fr的血管鞘(Cook Medical, Bloomington, IN)置于MICRA传送鞘内,防止回血。如需堵塞球囊(Bridge; Spectranetics Corporation, Colorado Springs, CO),则经右颈静脉送入Amplatz超硬导线 (Boston Scientific, Marlborough, MA)。随后,使用标准的拔除工具和技术拔除导线。拔除导线后,再次评估MICRA的电学参数。
记录人口学特征、手术相关参数和围手术期表现,分析血培养结果,记录再入院和感染复发事件。
研究结果
2018年1月至2019年11月期间,共植入224例Micra无导线起搏器。其中17名患者因感染同时接受了静脉导线拔除术。基线特征见(表1),患者的平均年龄为76.8±7.4岁,其中70.6%为男性。患者平均拔除导线数为3.06根(1-5根),导线平均使用时间为9.89年(3-41年),平均“导线年”(定义为每位患者拔除导线×使用时间的总和)为34.64年(5-97年)。在17例病例中,14例(82.4%)为完全起搏依赖,其余3例适应证分别是慢快综合征、房颤伴慢心室率及长间歇,间歇性房室阻滞致心脏性晕厥,心室起搏比分别为29%、30%和59%。7名患者接受三腔起搏器,双心室起搏反应良好。(表2)描述了每个患者CIED细节、感染源、血培养和超声结果。半数以上患者(11/17,64.7%)在植入MICRA前血培养阳性,4名患者(23.5%)在植入MICRA时血培养呈阳性,2名患者(11.8%)食超下可见导线赘生物(图1)。
表1 患者基线,植入装置详情及拔除适应证
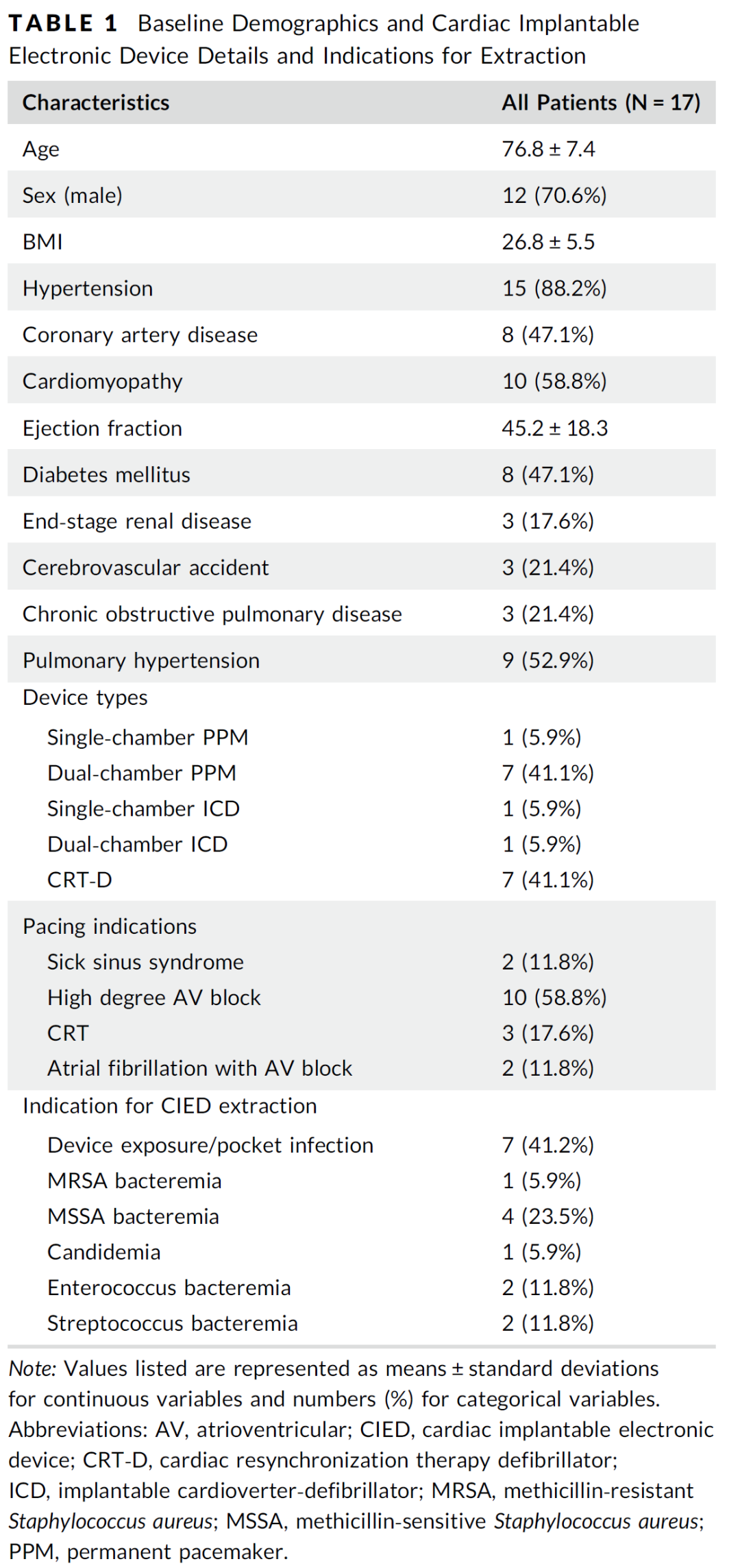
表2 患者植入装置及感染相关数据
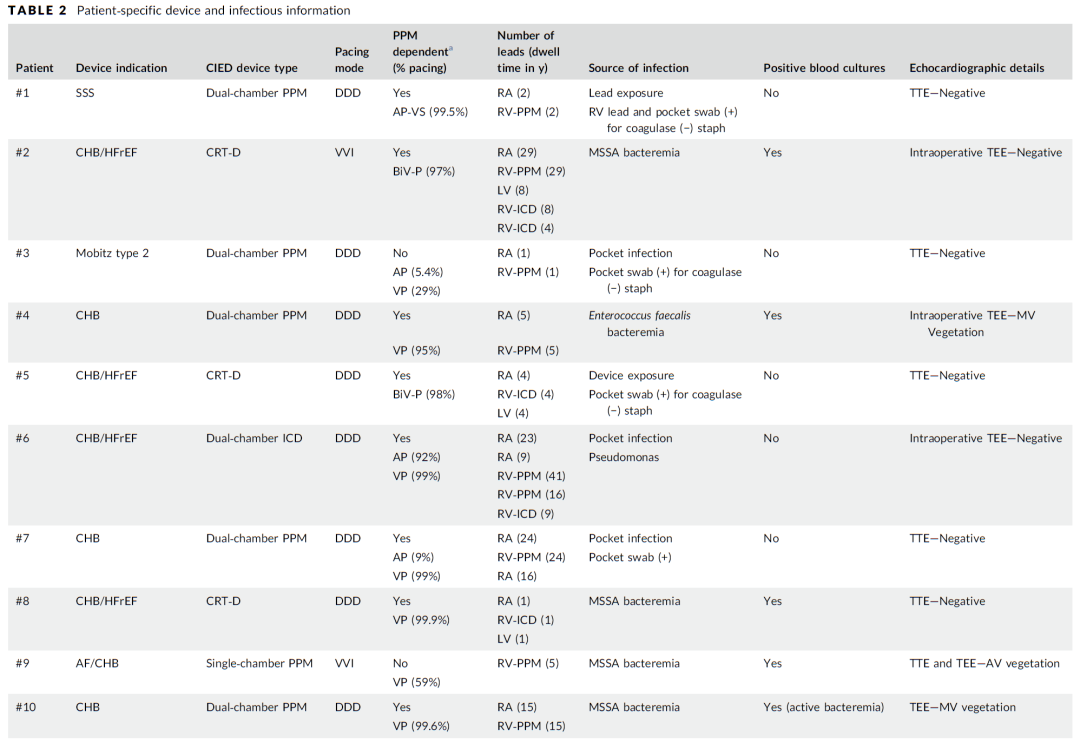
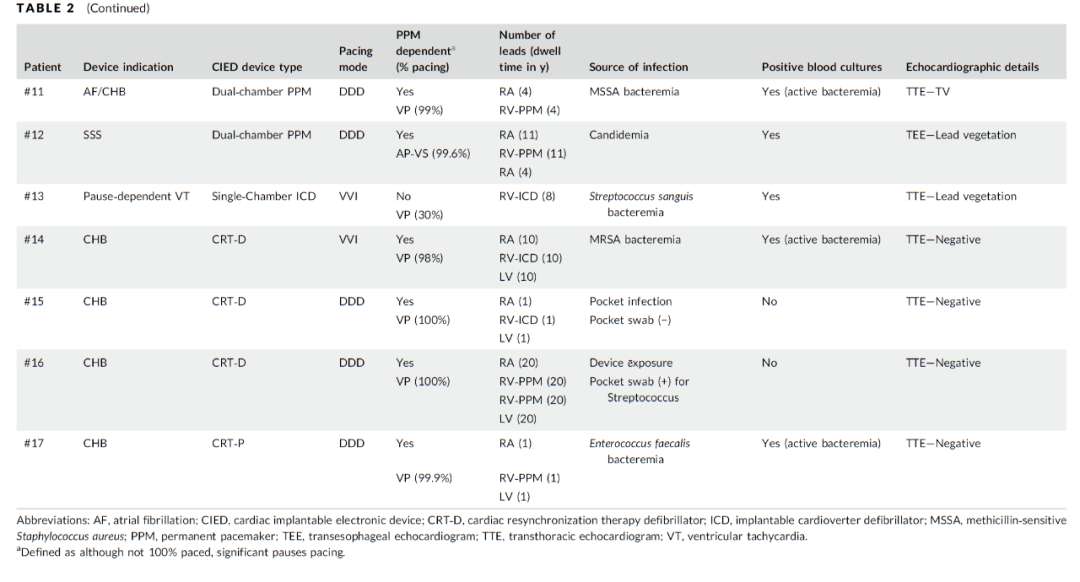
图1 Micra植入及感染导线拔除操作过程
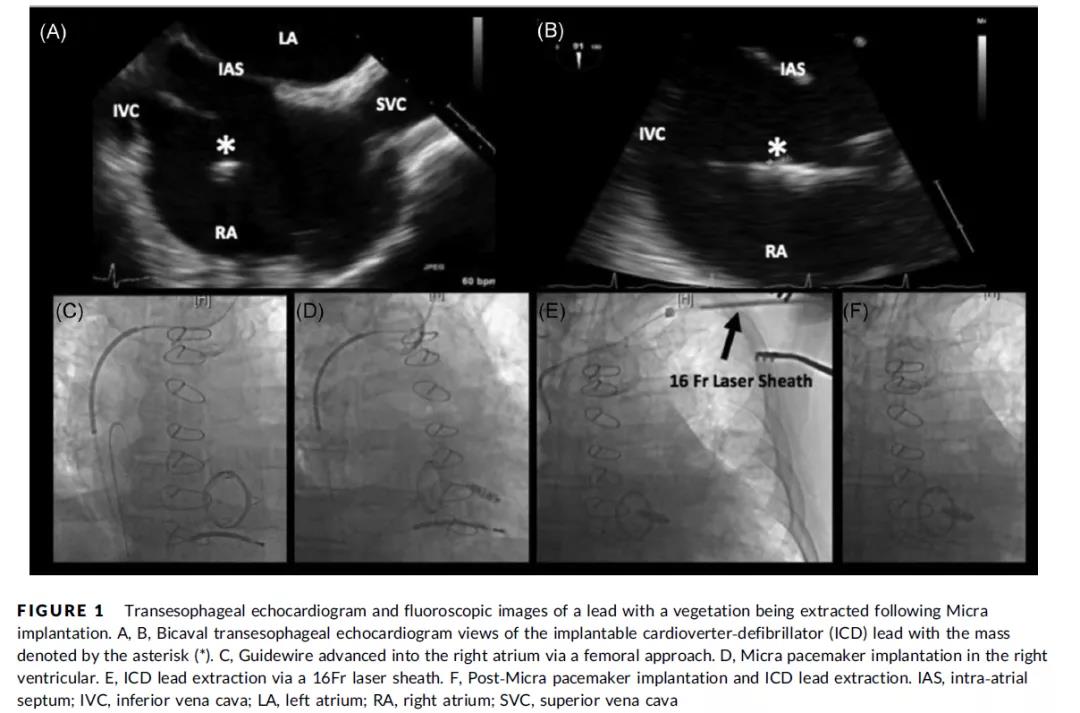
17例患者均成功植入MICRA,无手术并发症。拔除原导线未造成MICRA的移位,也未影响其心室感知、阻抗及起搏阈值。16名患者(94.1%)导线拔除成功,一位患者最终残留了一根41年前植入的导线头端。这位病人表现为慢性囊袋感染,导线拔除后门诊随访期间未发生再感染。
植入心律转复除颤器(ICD)的8名患者中,有2名患者在拔除导线前因持续性室速接受过除颤复律治疗,其余患者均为ICD一级预防,未有室性心律失常的治疗。接受ICD治疗的两名患者出院后佩戴穿戴式除颤救生衣(ZOLL Medical Corp, Chelmsford, MA)。在门诊完成抗生素疗程后,这两名患者经股静脉取出MICRA装置,并重植入传统ICD或CRT-D。另外6名患者没有再次行传统CIED植入,原因有新发恶性肿瘤诊断,无ICD指征,电生理检查未诱发室性心动过速等。
#12患者在拔除导线前因真菌感染导致脓毒性休克,拔除导线时已病危状态。#4患者术后至康复机构继续治疗,但在完成抗生素疗程之前,该患者于第32天不明原因死亡。其余15名患者在门诊中完成为期4到6周的抗生素治疗。#8患者在原CRT-D装置取出后第74天,因慢性心力衰竭急剧加重再次入院。在7名CRT装置摘除的患者中,#8患者是唯一因心衰恶化再次住院的。完成抗生素疗程的存活患者中,在为期143天(四分位数:57,181)随访期中,未见感染复发。
局限性
这是一项单中心的回顾性研究,随访时间相对较短。由于样本量小,而且其中一名患者死因不明,因此较难得出可信的死亡率数据。与CIED相关的再感染多在装置植入一年后发生,由于患者死亡,我们无法排除Micra设备感染导致的可能性。#12患者在拔除导线1天后死亡,鉴于存在真菌性脓毒血症,起搏设备导致死亡的概率极低。#4患者植入MICRA前9天血培养呈阴性,死亡时仍接受抗生素治疗,这也排除了因感染复发导致死亡的可能性。此外,本研究未比较移除原植入装置同时放置Micra无导线起搏器是否优于或等效于经静脉临时起搏器治疗后再择期行植入。而对这两种方案进行随机比较是有必要的。
无导线起搏的另一个缺陷是右心室起搏带来有害影响。#8患者在原 CRT-D取出后,进行了为期4周的抗生素治疗,随访中无感染再发。起搏QRS宽度从前双心室起搏的148ms增加到无导线右室起搏的186ms。在MICRA植入的72天后,患者因慢性心力衰竭急剧加重而再次住院。虽然可能存在多种因素导致本次再住院,但个例也说明需双心室起搏的患者如植入无导线右室起搏,将不利于预后。此外,尽管我们在13名原DDD模式的患者术后随访中没有观察到起搏器综合症,但仅VVI模式选择的无导线起搏器限制了其进一步的临床应用。
研究结论
本文分享了感染植入设备移除前同台行无导线起搏器植入的经验。入选人群大部分为起搏依赖患者,植入无导线起搏器时伴有活动性菌血症,但未见手术并发症,且随访中未有感染复发事件。初步经验表明:MICRA无导线起搏器可在原有导线拔除期间作为临时起搏,无脱位风险;在拔除原导线的同期植入MICRA无导线起搏器,可以避免起搏依赖患者对传统临时起搏的需求;这一策略有助于患者出院后继续完成抗生素治疗;但即便多数患者耐受VVI起搏,但在完成抗生素疗程后,移除或关闭MICRA,并行植入装置升级是可行的。
摘译自:Concomitant leadless pacemaker implantation and lead extraction during an active infection, David Chang , James K. Gabriels, Beom Soo Kim, Haisam Ismail, Jonathan Willner, Stuart J. Beldner, Roy M. John , Laurence M. Epstein. DOI: 10.1111/jce.14390