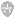起搏动态 | 王欢:心脏再同步化植入术中冠状静脉成形术:急性期结果和临床预后

心脏再同步化治疗(CRT)对于经优化药物治疗的宽QRS左心功能不全患者是一种有效的治疗方法。尽管CRT总体上能为患者带来获益,但仍有多达三分之一的患者对CRT无反应。CRT无反应的原因大致分为临床因素、电机械因素,以及器械相关的原因,例如患者不具备最理想的CRT适应症、药物治疗未达标、双室起搏比例不足及潜在的心律失常等。其中一个重要的原因是左室导线植入部位不理想,尽管植入了CRT,左室失同步依然存在。理想情况下,典型的左束支传导阻滞患者,左室导线应放置在左室侧壁电机械激动最延迟的部位,以增加CRT的反应性。然而,对于一些患者,由于左室导线植入的位置因局部心肌失夺获、左室导线稳定性不佳或膈神经刺激等原因,导致左室电极导线不能获得理想的起搏参数。此外,冠状静脉解剖变异也可能增加左室导线植入的难度,例如能够满足左室导线植入的冠状静脉分支血管太少,或冠状静脉细小,开口迂曲,存在静脉瓣膜或狭窄,都会使左室导线植入更加困难。
为了成功植入左室导线,可将左室导线植入到非最佳同步化的其他血管,经外科途径植入左室心外膜导线,植入左室心内膜导线,左束支区域起搏,以及使用介入技术,如经皮冠状静脉成形术(percutaneous coronary venoplasty,PCV)和导丝圈套技术,将左室导线植入首选的靶血管或心肌区域。已有单中心个案和系列的病例证明了PCV在优化LV导线植入中的可行性和实用性。然而,对于在CRT植入术中接受PCV的患者,其左室导线的长期性能和患者远期预后仍缺乏相关数据。本研究旨在评估患者在CRT植入术中进行PCV的安全性、有效性和长期预后。
方法
研究人群
这是一项亚洲人心衰CRT前瞻性评估(Prospective Evaluation of Asians with CRT for Heart Failure PEACH)注册研究,连续纳入2012年1月至2018年12月在新加坡一家学术医疗中心接受CRT植入的患者。所有患者均符合CRT植入指南,基于同样的国际共识,决定患者是否需要植入ICD (CRT-D)。将PEACH注册研究中,每个在CRT植入时进行冠状静脉成形术(PCV)的病例根据年龄、性别和束支阻滞形态与来自PEACH研究的另外2名对照患者进行匹配。记录患者的基本信息,CRT植入术中情况,起搏导线远期参数,临床反应性以及患者的预后。这项研究得到了新加坡国家医疗保健集团特定领域审查委员会的批准。
CRT植入及随访
经头静脉和/或腋静脉途径,分别将主动固定起搏导线置于右心房和右室心尖部。冠状静脉窦成功置入鞘管后,球囊行冠状静脉逆行造影,通过左前斜位和右前斜位造影图像,确定冠状静脉分支血管数量、血管分布、粗细、解剖特点及置入左室导线的可行性(图1)。常规策略是将左室导线尽可能植入靠近左室侧壁,基底段和中间段之间的部位。当左室导线植入困难时,先尝试常规技术,如双导丝技术、鞘中鞘技术、换更硬的导丝以提供更好的支撑,以及使用更细的4F导线等,如上述尝试均失败则决定行PCV。CRT的程控参数由术者决定。CRT植入后,患者至少在术后6个月进行超声心动图检查,以评估CRT的反应性,同时患者接受起搏器的远程监测和每年一次的起搏器访视。
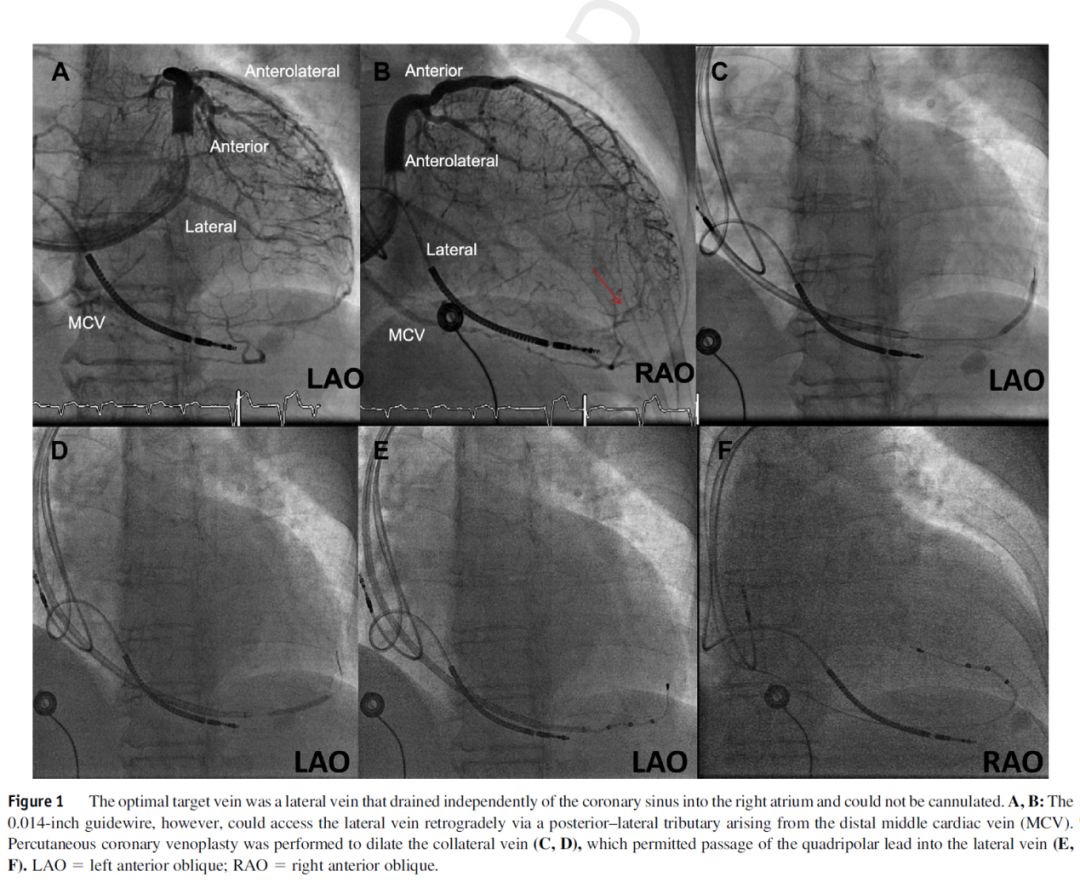
图1 最佳靶血管是侧静脉,但由于侧静脉起源变异未能成功置入鞘管,A,B;0.014-inch PTCA导丝通过心中静脉与后侧静脉的交通支逆行进入侧静脉.行PCV扩张交通支静脉(C,D)从而将左室四极导线植入侧静脉(E,F)。LAO=左前斜位;RAO=右前斜位。
PCV
左室导线植入术中,当靶静脉直径比左室导线细小,静脉局部狭窄或迂曲使得左室导线递送受阻时,需要考虑进行PCV。准备进行PCV的患者需要经LV导线递送鞘注射100u/kg肝素。成功植入左室导线后再经静脉注射鱼精蛋白逆转抗凝,剂量为每1000u肝素10mg鱼精蛋白。
在靶静脉内先将0.014-inch的PTCA导丝递送至静脉远端,随后用非顺应性球囊(通常直径2.0-2.5毫米,长度15-20毫米)在狭窄处进行扩张,球囊持续加压60秒,整个狭窄部位需进行反复球囊扩张,使静脉扩张后能通过左室四极导线(直径5.3F或1.8mm)。如静脉扩张受到阻力,则需要在透视下观察球囊腰部或球囊的压缩情况,随后尝试更大的扩张压力,如仍不成功可使用聚力球囊扩张法。该方法需要在非顺应性球囊旁增加一根硬的造影导丝,使球囊扩张时的力量集中在狭窄病变处。如果仍不成功,则可使用切割球囊。
PCV术后不需要常规行静脉造影,以减少造影剂的使用和避免手术操作拖延,造影可能会导致扩张的静脉回缩和潜在的血栓形成。取出球囊后,将左室导线通过导引钢丝植入到左室中部。经PCV后左室导线成功植入靶静脉,则认为PCV在急性期是成功的。
为了增加支撑力,术中常会将鞘中鞘置于靶静脉的开口。常规记录围手术期的并发症,如静脉或球囊破裂或心包积液等。
定量冠状静脉成像
定量冠状动脉分析在冠状动脉疾病领域已被常规应用和证实,但冠状静脉的定量测量未见报道。定量冠状静脉成像技术(Quantitative coronary venography, QCV)(IntelliSpace Cardiovascular 3.1;Philips Medical Systems,Nederland B.V.)是通过冠状动脉定量分析软件对冠状静脉造影图像进行离线分析。软件以导引导管或鞘中鞘作为校准(图2)。校准后,软件会半自动分析测量靶静脉的血管轮廓,并可进行手动矫正。经测量可获得靶静脉狭窄部分的最小管腔直径和靶血管近端或远端血管的平均直径。QCV不作为围手术期常规检查,也不用来指导植入器械的选择。
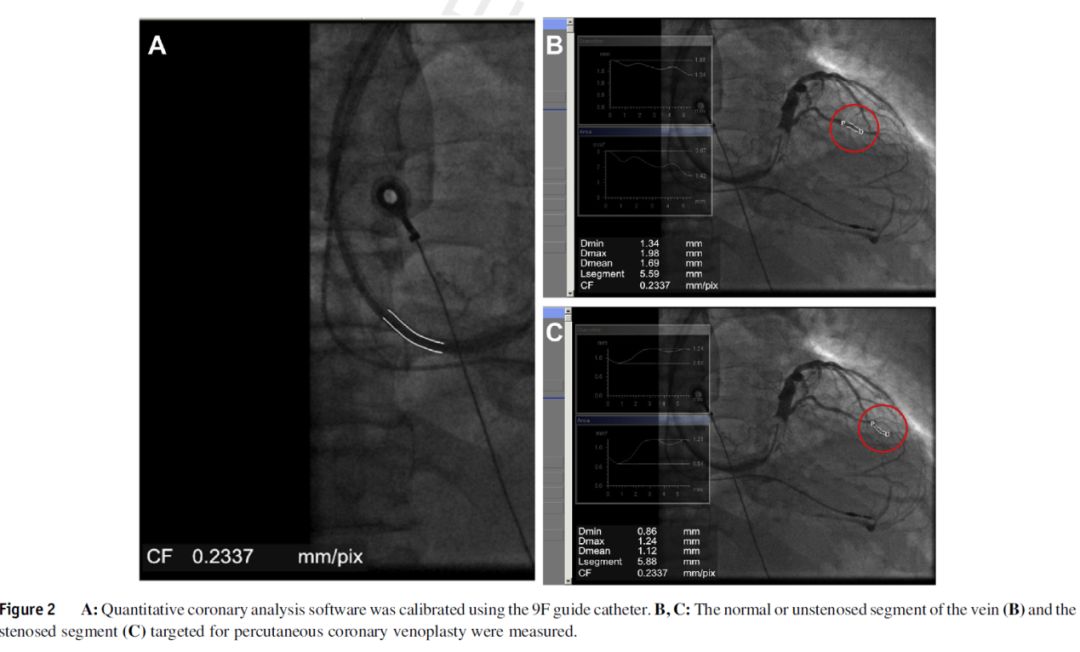
图2 A:冠状动脉定量分析软件用9F导引导管校准。B,C:正常的或没有狭窄的血管(B)对行经皮冠状静脉成形术的血管狭窄部分(C)进行测量。
定义
CRT有反应定义为与基线超声心动图相比,左室收缩末容积指数下降≥15%。慢性肾脏疾病定义为肾小球滤过率<60ml/min,至少3个月。
结果
基线患者特征
2012年至2018年共完成422例CRT植入,其中29例(6.9%)需要PCV辅助LV导线植入。PCV组和对照组患者的基线特征(表1)。PCV组更多患者既往植入心脏起搏器。在PCV组6例既往植入起搏器的患者中,1名患者因植入装置感染行左室导线重置,两次左室导线植入同一靶血管;2例患者因左室导线阈值升高,需重新置入LV导线至另一靶静脉(从侧静脉到前侧静脉、后侧静脉到侧静脉);3名患者为ICD升级至CRT-D。对照组中,3例患者为CRT升级。
表1 患者基线资料
PCV和手术细节
在29例需要PCV的患者中,21例(72%)成功地将LV导线植入靶静脉。PCV前靶静脉狭窄段的平均直径1.1±0.6mm,平均参考直径3.4±1.1mm。PCV使用的非顺应性球囊平均直径2.8±0.5mm,长度17.8±4.5mm。其中1例使用切割球囊,1例需要加压球囊技术。8例患者左室导线不能通过经扩张的静脉,其中7例更换了靶静脉,1例左室导线最后稳定置于接近狭窄节段靠基底部。
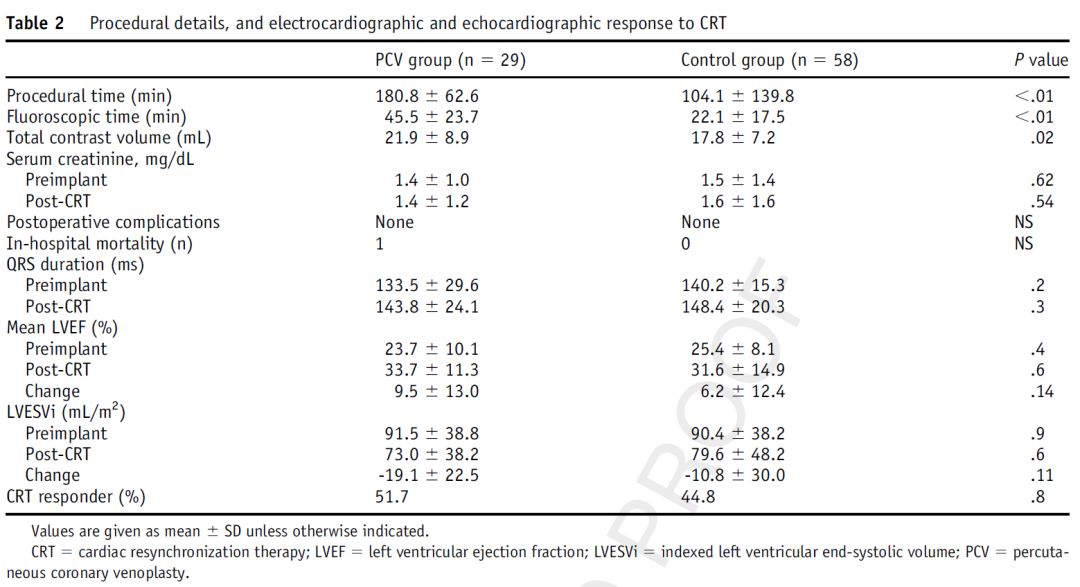
两组相比,对照组的透视和手术时间明显短于PCV组(表2)。
本研究大部分采用左室四极导线(PCV组62% vs对照组69%,P=0.5);其余采用LV双极导线。PCV组的造影剂用量略高于对照组(21.9±8.9ml vs 17.8±7.2ml;P=.02)。
两组均未发生包括造影剂肾病在内的围手术期并发症(表2)。PCV组1例患者因心衰恶化院内死亡。对照组无死亡。
表2 围手术期和CRT反应性结果
导线性能
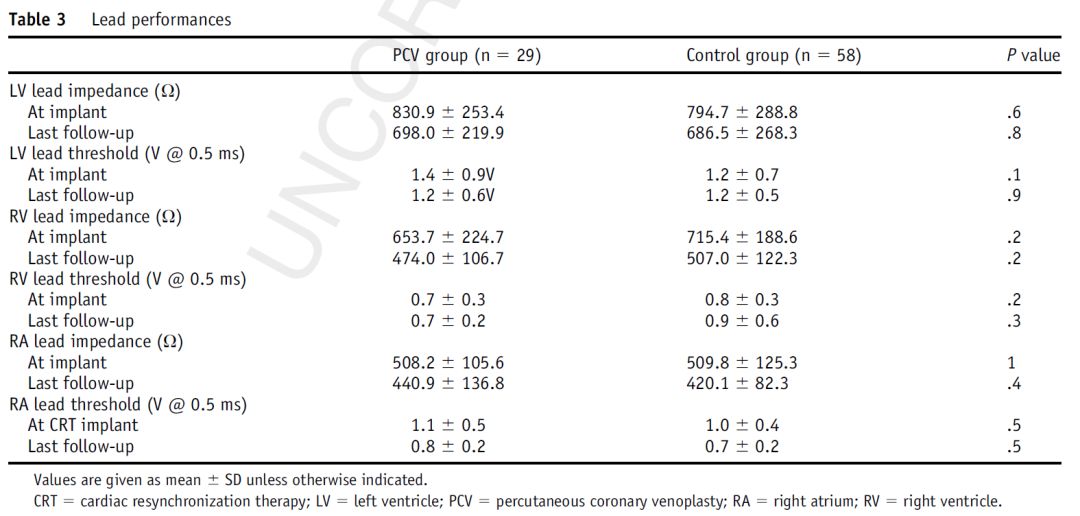
PCV组患者平均随访33.0±25.0月,对照组平均随访42.9±22.0月(P=0.1)两组间所有导线的起搏参数无差异(表3)。PCV组所有起搏导线在随访过程中参数均正常,无需调整。对照组2例左室导线因阈值升高进行了调整。
表3 起搏导线性能
CRT反应性
两组患者的左室射血分数均提高,左室内径均缩小。PCV组CRT反应性51.7%,对照组44.8%(P=0.8)(表2)。PCV组和对照组患者的平均左室射血分数分别提高9.5%±13.0% VS 6.2%±12.4%(P=0.14),左室收缩末期容积指数分别降低19.1±22.5ml/m2 VS 10.8±30.0ml/m2(p=0.11)。
临床结果
两组患者随访期间因心衰再入院(PCV 组0.46 vs对照组0.38;P=0..8)、1年生存率(PCV组 93.1% vs对照组96.6%;P=0.5)、2年生存率(PCV 86.0% vs对照组91.4%;P=0.5)均无显著差异。
结论
与对照组相比,CRT植入术中进行PCV是可行的、安全的,长期随访临床无差异。CRT术者具备PCV技术,可以优化LV导线植入,从而最大限度地提高CRT反应性。
摘译自:Coronary venoplasty during cardiac resynchronization therapy device implantations: Acute results and clinical outcomes. Heart Rhythm 2020;1–7